文. 徐小倩
' g/ ~) E7 B6 g3 t“与爱”导读
随着新一代抗肿瘤药物的兴起,肿瘤的治疗从细胞毒性药物治疗时代,跨越到了基于免疫系统的精准免疫治疗新时代,改变了肿瘤的治疗格局。美国癌症协会(ACS)在神刊CA(《A Cancer Journal for Clinicians》)上发布的2020年度癌症统计数据报告指出,肺癌的死亡率下降速度是最快的,免疫药物功不可没。(1990年至2017年,男性肺癌死亡率下降了51%;2002年至2017年,女性肺癌死亡率下降了26%。)
, E8 h0 f1 N4 d1 W7 l
2020已经进入尾声,与癌共舞论坛又与大家并肩走过了一年,感慨这不平凡一年的同时,肺癌的免疫治疗领域也取得了长足进展。作为新药研发大国的美国不仅有新药获批,也在已获批的免疫治疗药物扩展新适应症上下足了功夫。今天,我们一起“回望过去,展望未来”,盘点下这些年病友们“追过”的FDA(美国食品药品监督管理局)获批免疫治疗药物。
6 P+ M7 z: L2 O- u# y) h免疫治疗药物
# u+ }& \) e, y: u) ]
以免疫检查点抑制剂为代表的免疫治疗正在改变肿瘤治疗的现状,成为了驱动基因阴性以及靶向治疗失败患者的首选。如果把免疫系统比做一辆车的话,应该是既有油门又有刹车。每个免疫细胞(T细胞)的独特受体类似“油门”,可以与外来抗原结合,激活免疫反应。免疫检查点就相当于免疫系统的“刹车,对免疫系统进行调控,防止T细胞过度激活导致的炎症损伤等。“油门”和“刹车”的精准配合,才能控制车子的适度范围和速度。
- D( p+ c b( N) n' K) ]8 W
在肿瘤组织微环境下,由于T细胞表面的“刹车”(如PD-1)被肿瘤细胞产生的蛋白(如PD-L1)强行结合,抑制了免疫系统的反应,从而制动了抗肿瘤的免疫反应。免疫检查点抑制剂通过抑制免疫检查点活性,释放肿瘤微环境中的免疫“刹车”,重新激活T细胞对肿瘤的免疫应答效应,从而达到抗肿瘤的作用。
: S' y' d! r" v* @- _
目前,已有6种免疫检查点抑制剂获得了FDA的批准,分别为纳武单抗(Nivolumab )、帕博利珠单抗(Pembrolizumab)、阿特珠单抗(Atezolizumab)、度伐利尤单抗(Durvalumab)、伊匹单抗(Ipilimumab)、阿维单抗(Avelumab)。其中,除阿维单抗外,均可用于非小细胞肺癌(NSCLC)的治疗。值得期待的是,2021年开年,新款免疫检查点抑制剂——西米普利单抗(Cemiplimab)有望获批上市。
+ r2 u5 V6 o' x# o5 A. J m
1. 纳武单抗(Nivolumab,O药 )
" g% R8 c5 g2 V! J1 d# f
单药治疗——癌症治疗领域的里程碑
2015年3月,基于Check Mate 017/057的研究结果,纳武单抗被FDA(美国食品药品监督管理局)批准用于经治的晚期NSCLC患者的二线治疗,成为全球范围内首个获批用于肺癌的PD-1单抗;2018年6月,基于Check Mate 078的研究成果,纳武单抗获NMPA(国家药品监督管理局)批准,也成为中国首个用于NSCLC患者的免疫治疗药物。
8 J5 ^0 Z. v; h: \
Check Mate 017/057是关于纳武单抗的两项III期、开放、随机临床试验,区别为前者是针对鳞癌患者,后者是针对非鳞癌患者。两项研究的5年总生存期数据显示,纳武单抗的5年存活率碾压化疗(13.4%vs 2.6%),直接提升了5倍。
) n% A+ f [7 A; `; H3 s- MCheck Mate 017/057 OS随访数据
# w6 s2 i9 b. c" F8 ~# d# W7 xCheck Mate 078研究结果与Check Mate 017/057呈现了高度的一致性,区别为其是针对的是东亚人群,且受试者中有90%以上是中国人群,对我国患者有更大的借鉴意义。
8 a3 u8 _; I6 l* H0 N# \纳武单抗三项研究的结果显示,无论是东亚还是西方人群、鳞癌还是非鳞癌患者、PD-L1阳性还是阴性,纳武单抗免疫治疗均显著优于化疗。纳武单抗上市毋庸置疑成为了全球癌症治疗领域的里程碑,填补了国内外肺癌免疫治疗的空白,为更多晚期NSCLC患者带来长期生存的希望。
( }+ P6 i" p8 w J; ^" \" j双免疫联合治疗——引领双免疫时代
纳武单抗除了二线单药治疗外,其在NSCLC一线双免疫联合治疗方面也取得了重大突破。基于Check Mate 227/9LA研究,2020年5月,FDA正式批准“纳武单抗+伊匹单抗(Ipilimumab,Y药)”与“纳武单抗+伊匹单抗+短疗程化疗(2周期)”用于一线EGFR/ALK阴性的成人转移性NSCLC的治疗。
: ]) l' s+ t! s* K3 f: k两项研究均显示,无论患者PD-L1表达情况,纳武单抗+伊匹单抗(±短疗程化疗)均可改善其OS。更值得一提的是,亚裔人群的数据与全球整体人群一致,且部分更优。
/ r4 L9 R6 c9 a/ Y纳武单抗+伊匹单抗(±短疗程化疗)实现了晚期驱动基因阴性的NSCLC全人群的明确生存获益,成为全球首个也是目前唯一获得FDA批准的双免疫治疗方案,正式拉开了肺癌双免治疗时代的序幕。
; k' L6 I( @) V8 P0 d8 b: d* b
2.帕博利珠单抗(Pembrolizumab,K药 )
1 D n' r8 `6 J( w5 ^4 {% ]! q
不得不说,帕博利珠单抗是免疫治疗圈里知名度高、故事多的明星PD-1抑制剂,因为截止目前,其是FDA获批适应证最多的药物,横跨各大癌种,为NSCLC患者带来了长期的生存获益。
6 \& ?- L/ b h/ e% {帕博利珠单抗在晚期NSCLC治疗中也可谓获得了大满贯,2015年10月,帕博利珠单抗首获批用于晚期NSCLC二线单药治疗(PD-L1≥1%),自此便开始了其在NSCLC治疗领域的封神之路;时隔1年,2016年10月,帕博利珠单抗获得了PD-L1≥50%一线单药治疗的适应症;随后,2018年,8月、10月,帕博利珠单抗又先后获批了与化疗药联合的一线治疗方案;探索的脚步从未停止,2019年4月,基于KEYNOTE-042研究结果,帕博利珠单抗将一线单药适应症从PD-L1≥50%人群扩展到了PD-L1≥1%的人群中。
$ S8 \& B7 k# Q: m e) _免疫药中的“后浪”不断涌现,帕博利珠单抗这位“前浪”也在不断开疆拓土,从二线到一线,从单药到联合治疗,我们也期待其今后的优异表现。
4 _: b5 d8 N5 X: D: d' F+ F6 T; s单药治疗——不断斩获适应症
/ k7 s0 c4 \$ T; \9 l. E% F6 m
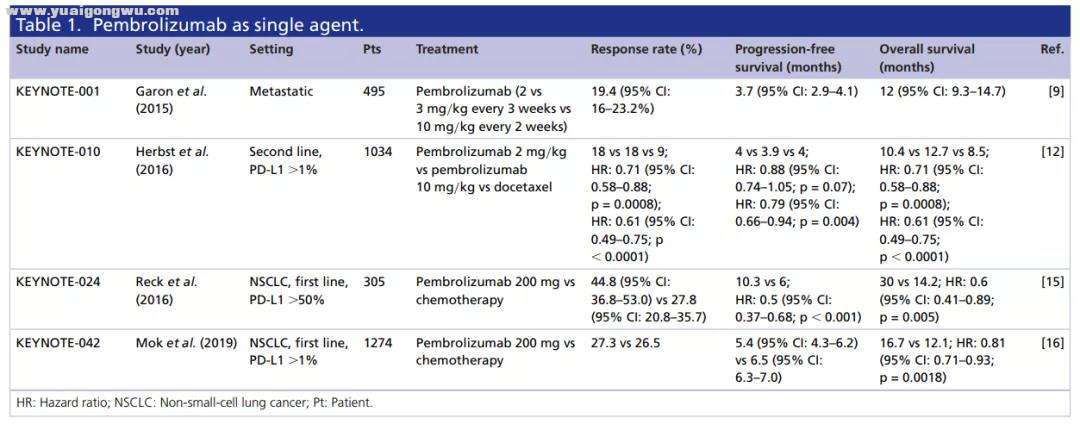
帕博利珠单抗单药治疗
' H% F5 t+ K% x2 ~' x& Q6 G联合化疗——再登高峰
/ _9 ]5 l4 P3 [( U) y! R9 K
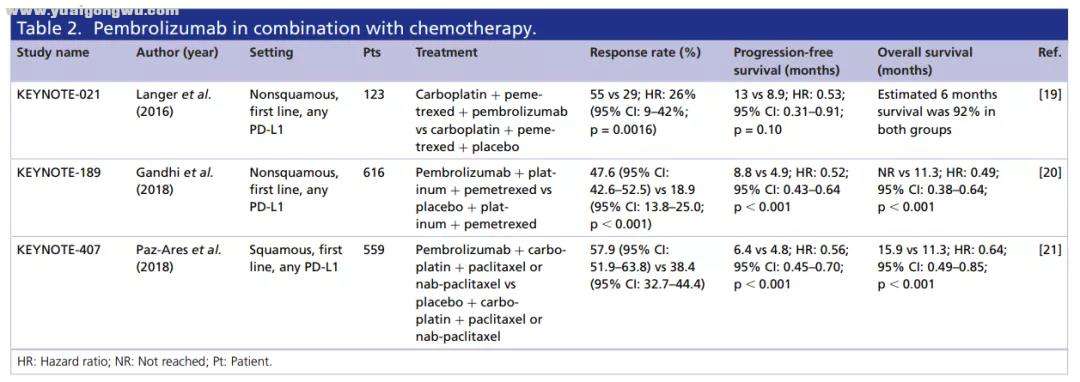 & [: P0 h: |4 g+ l1 k4 k% T4 q
& [: P0 h: |4 g+ l1 k4 k% T4 q
帕博利珠单抗联合化疗
4 e/ }7 w2 c. G5 L在研项目——探索永不止步
正在进行的帕博利珠单抗临床试验
* L. ]- u' j# s( ]( ?9 n3.阿特珠单抗(Atezolizumab,T药 )
) v5 ]7 D7 _# [7 s2 w0 F! S4 d+ g单药治疗——后劲充足
阿特珠单抗作为PD-L1免疫治疗药物, 于2016年被FDA批准用于转移性NSCLC含铂方案化疗期间或之后病情进展, EGFR突变/ALK阳性经TKI等治疗后的二线治疗,该适应症获批是基于两项全球、多中心、随机对照、III期临床试验——OAK和POPLAR 。研究显示,无论患者的PD-L1状态如何,包括鳞状和非鳞状NSCLC,阿特珠单抗治疗相较于多西紫杉醇化疗的患者总生存期更长。(OAK:13.8 vs 9.6个月;POPLAR:12.6 vs 9.7个月 )。
1 x5 z4 z( w( z% |" b
值得欣喜的是,阿特珠单抗于2020年5月再下一城,获批新的适应症:一线治疗PD-L1高表达且无EGFR/ALK基因突变的转移性NSCLC成年患者。作为首个获批用于NSCLC的PD-L1单抗免疫治疗药物(纳武单抗与帕博利珠单抗为PD-1单抗),NSCLC一线治疗又多了一个选择。
, y+ s0 N9 H5 i, ?9 P$ Z! K
PD-L1高表达组OS数据
阿特珠单抗 vs 化疗,20.2个月 vs 13.1月
+ W% I- Q; ~" C1 f6 r# K联合化疗——优势突出
除单药治疗外,阿特珠单抗联合化疗治疗方案也取得了不错的成绩,基于IMpower131/150两项研究,于2018年12月,“阿特珠单抗+贝伐单抗+卡铂+紫杉醇”联合治疗方案获批,用于无EGFR或ALK基因突变的转移性非鳞状NSCLC患者的一线治疗;1年后,“阿特珠单抗+白蛋白紫杉醇+卡铂”联合治疗方案获批,同样用于无EGFR或ALK基因突变的转移性非鳞状NSCLC患者的一线治疗。
4 e: I0 ?6 _! l- E
两项研究结果均显示,对于晚期NSCLC患者,初治采用化疗联合PD-L1药物-阿特珠单抗,是具有明确优势的新治疗方案,为驱动基因阴性的NSCLC患者一线治疗带来巨大革新。
$ h X; V: h+ v8 A
4.度伐利尤单抗(Durvalumab,I药 )
$ t- b+ z9 j4 E1 y: q' r度伐利尤单抗作为上市的第二款PD-L1单抗,为III期NSCLC患者缔造了“治愈”的希望。基于PACIFIC研究,2018年2月,FDA批准度伐利尤单抗治疗肿瘤不可切除,放化疗后病情无进展的III期NSCLC患者。
2 G+ e4 s& G/ L
今年刚结束不久的ESMO大会上,公布了PACIFIC研究的最终数据。度伐利尤单抗组中位OS时间达到47.5个月,总生存期近4年,较安慰剂组(29.1个月)生存期整整延长了18.4个月。4年OS率也相当惊艳,高达49.6%。
. r, _2 l" B7 x& L# y. T; E( NPACIFIC研究OS最终数据
5 {1 _& e' t E/ WPACIFIC研究结果突破了III期NSCLC十几年来的治疗瓶颈,更值得一提的是,这是FDA针对特定患者人群,批准的首款用于降低癌症进展风险的疗法。度伐利尤单抗改变了局部晚期NSCLC治疗格局,免疫治疗已经从NSCLC姑息治疗的角色扩展到参与根治性治疗的角色上。
2 ~6 |4 V1 d) ?
5. 西米普利单抗(Cemiplimab)
' K% k4 _" c% @
对于西米普利单抗,病友们可能不甚熟悉,其是一种高亲和力、高效力的人源性PD-1抑制剂。2020年10月30日,美国FDA授予其优先审查资格,并将于2021年2月做出审查批复。如果一切顺利,其将成为最新一款获批PD-1抑制剂,用于一线治疗PD-L1表达≥50%的局部晚期或转移性NSCLC患者,让我们翘首以待吧!
/ v! f7 L. s5 p3 E0 `- G# {新年愿望
$ n1 J0 R) n- G | W虽然2020一整年都笼罩在新冠疫情的阴霾下,但肿瘤治疗新药不断涌现,新适应症不断获批,给了我们足够的底气去心怀希望。当然这份希望,不止来源于医学的进步,也是来源于病友们的坚持、来源于家人的呵护。我们也坚信,病友们在这种充满爱的大环境下,可以与癌共舞,与爱共舞,突破绝境,为生命续航!
! @1 V( W7 J) m4 y9 l! C2 [9 X
致病友及家属
- t3 p+ ], F6 ^5 |; d抗击癌症,从来不是段轻松的旅程。
纵使有眼泪,有心酸,
但也有打不倒的毅力、
冲不散的真情。
2020年,您所有的努力,
时光都记得。
2021年,愿您
身之病痛,皆可治愈。
心之所向,皆可实现。
$ N! n' ~5 H4 i% ?- o& L
# B/ A; |% ]/ H/ U) f0 y
1 X! Z) G: V2 ?6 p( I. v
* j$ d' d' e4 R. ^ G3 s; L